Vaccin Astrazeneca Covishield : l’homologation européenne en cours
- Par Sonia OMBOUDOU
- 02 juil. 2021 11:40
- 0 Likes
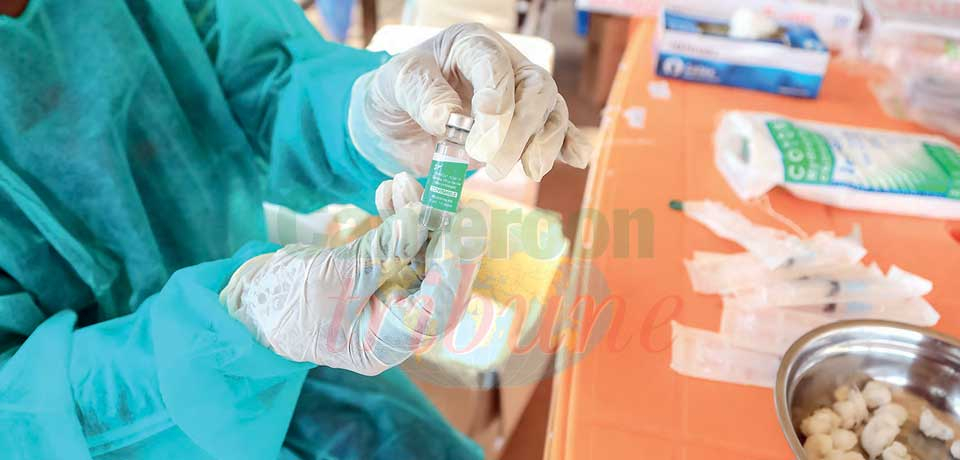
Les responsables du Programme élargi de vaccination et de l’OMS affirment que le processus a déjà été lancé auprès de l’Agence européenne médicament.
L’information fait les choux gras de la presse internationale depuis deux semaines. L’Agence européenne des médicaments ne reconnait pas le vaccin AstraZeneca Covishield, distribué en majorité en Afrique, dans le cadre de la facilité Covax. La nouvelle a été confirmée par l’ambassade de France à Madagascar le 16 juin dernier. L’information est d’autant plus sensible que sur les 27 pays à avoir bénéficié de différents vaccins du dispositif Covax, 23 n'ont reçu que des doses Covishield. Codirigé par l'OMS et l’alliance Gavi, le vaccin en question a entre autres, été financé par l'Union européenne à hauteur de 2,47 milliards d'euros, soit 7,871 milliards de F. Le dispositif a la particularité d'être produit en Inde, par le Serum Institute of India. Si, a priori, la molécule contenue dans le sérum est la même que celle du Suédo-britannique Vaxzevria utilisé en France, le Covishield en revanche n'est pas reconnu par les autorités sanitaires européennes. Une réalité qui a un impact non négligeable sur l'accès à la zone Schengen avec l’instauration du « Pass sanitaire » depuis le 1er juillet dernier.
Entre rumeurs et débats sur les réseaux sociaux, les voyageurs camerounais sont également aux abois. Les sites de vaccination comme l’esplanade du Palais polyvalent des sports de Yaoundé se transforment depuis lors en lieu de renseignements. « Ici, on nous fait savoir que c’est le vaccin Sinopharm qui n’est pas reconnu par l’Union européenne et non AstraZeneca. Pourtant, plusieurs sites d’informations crédibles français parlent du Covishield. On est perdu », déplore une mère de famille dont le départ pour la France est prévu pour le 10 juillet prochain. Au niveau de la délégation de l’Union europ&eac...
Cet article complet est réservé aux abonnés
Déjà abonné ? Identifiez-vous >
Accédez en illimité à Cameroon Tribune Digital à partir de 26250 FCFA
Je M'abonne1 minute suffit pour vous abonner à Cameroon Tribune Digital !
- Votre numéro spécial cameroon-tribune en version numérique
- Des encarts
- Des appels d'offres exclusives
- D'avant-première (accès 24h avant la publication)
- Des éditions consultables sur tous supports (smartphone, tablettes, PC)














Commentaires